Factores de los que depende la velocidad de reacción
TAMAÑO DE LAS PARTICULAS
Cuando una o todas las sustancias que reaccionan se encuentran en estado solido, la velocidad de reacción depende de la superficie expuesta. Cuando los solidos son molidos o triturados en forma de granos, aumenta la superficie de contacto y, por consiguiente, las colisiones, con lo que la reacción es mas rápida.
ESTADO FISICO DE LOS REACTIVOS
La velocidad de reacción depende del tipo de enlaces y del estado físico que representen los átomos, moléculas e iones participantes.
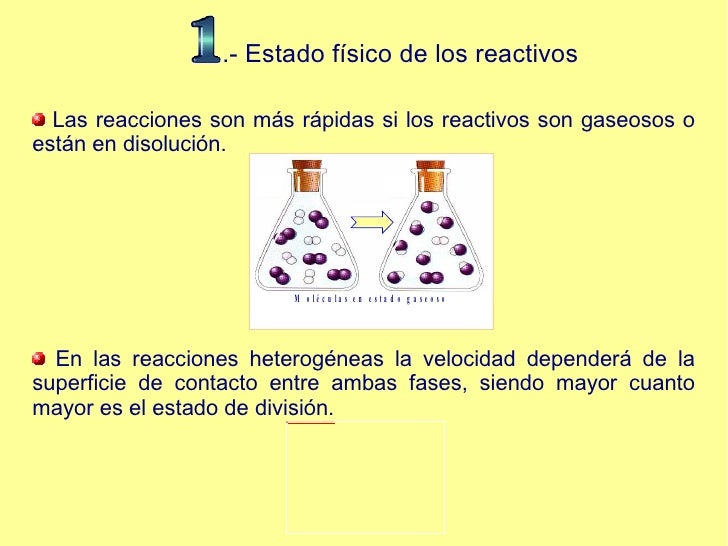
En las reacciones heterogéneas, la velocidad de reacción depende de la superficie de contacto entre las dos fases. Es mas rápida cuando menores sean las partículas del solido. En general, las reacciones en estado gaseoso tiene mayor velocidad de reacción.
Las reacciones entre iones en disolución acuosa involucran la disociación de los compuestos en el agua como primer paso. Esta disociación hace que las reacciones de este tipo sean prácticamente instantáneas.
En algunos casos, los enlaces pueden romperse con facilidad para dar paso a la formación de otros nuevos, pues la energía de activación necesaria para que la reacción se efectué es muy baja. La velocidad de reacción se vera afectada en consecuencia por esta capacidad, a la que comúnmente se le denomina REACTIVIDAD.
Por otro lado, la velocidad de reacción entre moléculas suele ser muy lenta, ya que requieren mas energía para romper algunos de sus enlaces.
TEMPERATURA
Al aumentar la temperatura, se incrementa la velocidad de desplazamiento de las partículas; por lo tanto, aumenta la frecuencia y la energía de las colisiones. El resultado es una mayor velocidad de reacción. Se dice, de manera aproximada, que por cada 10°C de aumento en la temperatura, la velocidad se duplica.
Cuando se eleva la temperatura en una reacción, las moléculas pueden chocar con la energía suficiente para que se efectúen rupturas en los enlaces y se formen nuevas moléculas, aumentando así la velocidad de la misma.
CONCENTRACION DE LOS REACTIVOS
Al aumentar la concentración de un reactivo se acelera la velocidad de reacción. Mientras que mas moléculas de reactivo haya en un volumen especifico de liquido o gas, mas colisiones ocurrirán por unidad de tiempo.
Si en la reacción participa un gas, la concentración se puede incrementar si se aumenta la presión. Esto no aumenta el numero de partículas, pero las acerca mas, por lo cual aumenta la frecuencia de las colisiones, debido a la disminución en el volumen. Al aumentar la concentración de los reactivos se incrementa la frecuencia de colisiones y la reacción es mas rápida.
CATALIZADORES
Los catalizadores son sustancias que se pueden agregar a una reacción para aumentar la velocidad de reacción sin que se consuman en el proceso.
Los catalizadores pueden afectar favorablemente al entorno de reacción, Desde el punto de vista de la cinética, las reacciones catalíticas se comportan como las reacciones químicas típicas, es decir, la velocidad de reacción depende de la frecuencia de contacto de los reactivos en la etapa determinante de velocidad.
Normalmente, el catalizador participa en esta etapa lenta, y las velocidades están limitadas por la cantidad de catalizador.
En la catálisis heterogénea, la difusión de los reactivos a la superficie de contacto y la difusión de los productos desde dicha superficie puede ser la etapa determinante de la velocidad. Situaciones similares relacionados con la unión del sustrato y la disociación del producto se aplican en la catálisis homogénea.
Aunque los catalizadores no son consumidos por la propia reacción, pueden resultar inhibidos, desactivados o destruidos por procesos secundarios. En la catálisis heterogénea, procesos secundarios típicos incluyen el coqueo, donde el catalizador se cubre por productos secundarios poliméricos. Además, los catalizadores heterogéneos pueden disolverse en la solución en un sistema sólido-líquido o evaporarse en un sistema sólido-gas.
Aunque los catalizadores no son consumidos por la propia reacción, pueden resultar inhibidos, desactivados o destruidos por procesos secundarios. En la catálisis heterogénea, procesos secundarios típicos incluyen el coqueo, donde el catalizador se cubre por productos secundarios poliméricos. Además, los catalizadores heterogéneos pueden disolverse en la solución en un sistema sólido-líquido o evaporarse en un sistema sólido-gas.
La naturaleza química de los catalizadores es muy diversa así como la catálisis misma, aunque pueden hacerse algunas generalizaciones. Los ácidos son probablemente los catalizadores más ampliamente usados, especialmente para muchas reacciones que involucran agua, incluyendo la hidrólisis y su inversa.
Los sólidos polifuncionales por lo general suelen presentar actividad catalítica por ejemplo las zeolitas, la alúmina y ciertas formas de carbono grafítico.
Los metales de transición son utilizados a menudo para catalizar reacciones de óxido reducción, (oxigenación, hidrogenación).
Los sólidos polifuncionales por lo general suelen presentar actividad catalítica por ejemplo las zeolitas, la alúmina y ciertas formas de carbono grafítico.
Los metales de transición son utilizados a menudo para catalizar reacciones de óxido reducción, (oxigenación, hidrogenación).

.jpg)
Comentarios
Publicar un comentario